一、分析數據之品質管制
1.檢量線範圍
檢量線的線性相關係數(r值)不得小於0.995。標準溶液濃度的配製值和量測值的平均相對誤差(relative error),相對於最高濃度之相對誤差不得大於 3%,其餘濃度之相對誤差減去最高濃度的相對誤差不得大於下列標準。
| 濃 度 | 相對誤差 |
| 1/2 ~ 2 PEL | 7.0 % |
| 其 它 | 10.0 % |
相對誤差=(│量測濃度-配製濃度│/配製濃度)×100%
例:設檢量線標準溶液的最高濃度為50 mg/mL,它經檢量線計算後的計算值為51 mg/mL,則最高濃度的相對誤差為
〔(51-50)/50〕×100%=2%
則檢量線最低濃度的相對誤差須不大於 12%。
2.脫附效率之品質管制
如須有脫附過程,應做脫附效率之品質管制。
(1)樣品脫附效率的添加質量是相當於在最低採樣流率下,對1/2、1和 2倍PEL濃度的氣體進行八小時採樣所得。若使用添加法,則其 CV 值需不大於 7.0%;若使用標準氣體吸附方法,則需不大於 10.5%。同時脫附效率需不小於 75%。
(2)上述三個濃度之個別平均脫附效率之最大者和最小者之差相對於最大者,需不大於7.0%。即

(3)平均脫附效率 (pooled desorption efficiency)之計算如下:
a.符號說明
X:配製濃度
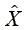 :量測濃度
:量測濃度
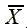 :平均量測濃度
:平均量測濃度
m:同一配製濃度重複製備之樣品數 (一般m取6)
n:不同之配製濃度 (一般n為3)
SD:標準偏差
CVa:分析變異係數
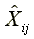 :配製濃度Xi之第j個重複配製樣品之量測濃度(設只量測一次)
:配製濃度Xi之第j個重複配製樣品之量測濃度(設只量測一次)
mi:配製濃度Xi計重複製備 mi個樣品
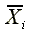 :mi個Xi的平均量測濃度,
:mi個Xi的平均量測濃度,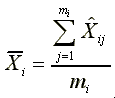
SDi:量測配製濃度Xi樣品之標準偏差,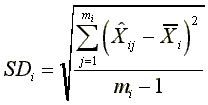
CVi:量測配製濃度Xi樣品之變異係數,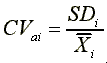
a.計算:
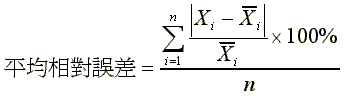
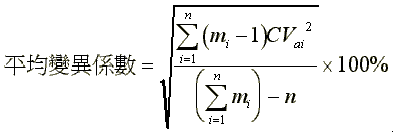
c.範例:
設三氯乙烯 (trichloroethylene) 3種不同濃度的脫附效率測定數
據資料如下:
配製濃度(μg/mL) X1=292.00 X2=584.00 X3=1168.00
量測濃度(μg/mL)
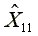 =307.85
=307.85 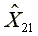 =580.62
=580.62 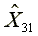 =1170.10
=1170.10
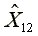 =303.93
=303.93 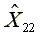 =578.13
=578.13 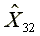 =1165.25
=1165.25
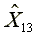 =301.15
=301.15 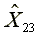 =576.05
=576.05 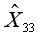 =1164.95
=1164.95
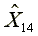 =293.12
=293.12 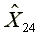 =5810.37
=5810.37 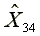 =1172.39
=1172.39
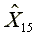 =2810.13
=2810.13 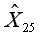 =586.24
=586.24 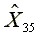 =1174.86
=1174.86
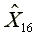 =297.14
=297.14 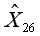 =577.38
=577.38 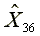 =1163.29
=1163.29
測定次數 m1=6 m2=6 m3=6
n=3
平均量測濃度X1=(307.85+303.93+301.15+293.12+2810.13+297.14)/6=298.72
X2=581.30
X3=1168.47
標準偏差 SD1={[(307.85-298.72)2 +(303.93-298.72)2 +(301.15-298.72)2 +(293.12-298.72)2 +(2810.13-298.72)2 +(297.14-298.74)2]/(6-1)}0.5=6.96
SD2=5.35
SD3=4.66
分析變異係數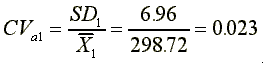
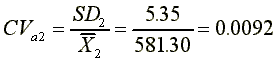
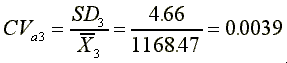
平均變異係數
CVa={[(6-1)×0.0232+(6-1)×0.00922+(6-1)×0.00392]/(6+6+6-3)}0.5×100%=1.44%
平均相對誤差
{(│298.72-292│/292+│581.30-584.00│/584+│1168.47-1168│/1168)×100%}/3=0.93%
二、儀器分析準則
(一)方法訂定及驗證
1.分析法需量測以下事項,(1)檢量線線性範圍(2)脫附效率 (DE) 和 CV 值(3)分析方法可量化最低濃度(4)最佳分析條件等, 茲說明如下:
(1)檢量線線性範圍
a.最低濃度:最低採樣體積×PEL×1/10。
b.最高濃度:最高採樣體積×PEL×2。無機分析時,若最高濃度已超過檢量線之線性範圍,請稀釋之。並以新所得之濃度最高者為檢量線最高濃度。
c.檢量線之最高濃度的配製值和量測值的相對誤差需小於 3%。
d.除了在最高和最低濃度各配製一瓶標準溶液外,於此濃度範圍內,另配製3個不同濃度的標準溶液,若測定含氯、氟之化合物,宜多配製數瓶不同濃度的標準溶液。
e.最低濃度之標準溶液需再配製一瓶。
f.若最低濃度之數據不符合〝分析數據品質管制〞,則需以較高的濃度為新的〝檢量線最低濃度〞。
g.若最低濃度相對誤差減去最高濃度的相對誤差仍小於 10%,則以最低濃度為本方法之檢量線最低線性濃度。
h.若分段使用線性迴歸方式計算檢量線之相對誤差時,同一個濃度可能會被數條不同的檢量線所計算;則取最小之相對誤差為該濃度的相對誤差。
i.配製各標準溶液時,均應從儲備溶液直接配製。
2.脫附效率
(1)添加量
分析物之添加量相當以在1/2倍、1倍、2倍的 PEL 氣體濃度下,依建議的最低採樣體積所含的分析物質量,每一濃度各做6個,並有3個空白樣品。
(2)若使用內標物法 (internal standard method) ,需加以說明。
(3)需註明採樣介質的廠牌及型號。
3.分析方法可量化最低濃度
於檢量線線性範圍之低濃度附近,添加化合物於採集介質中,製備三個樣品。經脫附,並以脫附效率校正後,以不大於10%的平均相對誤差及7.0%的平均變異係數為本方法之可量化最低濃度。
4.最佳分析條件
分析條件需可分離分子式極為接近之可能共存之干擾物。如分析乙酸時,管柱的層析條件需可同時分離甲酸和丙酸。
(二)樣品分析
1.檢量線和品管樣品需符合品質管制標準,才可進行待測樣品的分析。
2.全部的檢量樣品、品管樣品、試劑空白樣品、現場空白樣品和空白樣品之總合需不少於總樣品數之15%。現場空白樣品應為每批採樣樣品中10%或至少二個以上。
3.檢量線濃度範圍需涵蓋待測物之濃度,不可用外插法推估待測物濃度。
分析氣態有機化合物採樣分析之介紹
氣態有機物不祇具有易燃易爆的特性,往往對人體的健康危害也相當大,如氯乙烯、環氧乙烷、溴化甲烷和丁二烯等。氣態化合物係指在常溫壓下,化合物以氣態存在,在環境測定和實驗室分析上,氣態化合物均帶給工業衛生師和化學師相當大的挑戰。因它們的沸點低而不易被採集,且它們的化學分析檢量線製備不易;因此,也就不易被精確的定量。
於此探討採樣分析建議方法中所面臨的三個氣態化合物之基本化性,並就共通的定量分析方法做一介紹,各個化合物之詳細的分析條件,請參考採樣分析建議方法。由下述之氣態有機化合物的化性和物性之了解,在採樣分析時,需特別小心。
範例如下:
1.氯乙烯 (vinyl chloride)
基本性質
狀態:氣態
沸點:-14℃
蒸氣密度:2.2 (空氣=1)
溶 解 性:溶於醇類、乙醚、四氯化碳、苯、微溶於水
由化學結構上可明顯的看出由於烯類的兩個C元素上的π電子雲與Cl原子之空π軌域交互作用,而使其化性活潑,因此只要提供少量的能量如加熱或照光,就可使其反應;常見的反應如聚合反應。其對人體的毒性效應已發現有肺、腦、淋巴系統等的癌症現象及肝腫大的傷害。
2.1,3-丁二烯 (1,3-butadiene)
基本性質
狀態:氣態
沸點:-4.4℃
蒸氣密度:1.9 (空氣=1)
溶 解 性:溶於乙醇、乙醚、不溶於水
其化學結構所顯示的四個π軌域是共軛之狀態,因此在四個C之間的電子雲就相當的活潑,因此它的反應性也就相當高,約和氯乙烯相似。
3.溴化甲烷 (methyl bromide)
基本性質
狀態:氣態
沸點:3.6℃
蒸氣密度:3.3 (空氣=1)
溶 解 性:溶於酒精、三氯甲烷、乙醚、
二硫化碳、四氯化碳、苯
其結構上C-Br的鍵較長、能量較低且Br是一個容易解離的解離基 (leaving group) 因此,當有微少的能量或外誘因子時就可將它的結構破壞,溴化甲烷對人體的傷害,局部可能會導致結膜炎、皮膚病變;而嚴重時則會傷及心智、視力、聽力神經、呼吸器官、腸胃以及泌尿系統等。
氣態化合物在採樣分析上所可能遭遇的問題主要有:(1)樣品之有效採集(2)樣品之穩定性(3)檢量溶液製備之準確性。
一、樣品採樣
(一)氣態化合物的採樣方法主要有下列幾種:
1.液體捕集法
是將待測空氣樣品通過一定量的吸收液,而利用其與該液體接觸時之溶解、反應或吸收等特性來捕集所欲測定物質的方法。常用的液體捕集器具可分為小型氣體吸收管、小型氣泡瓶、小型衝擊式捕集器、氣泡瓶等。雖然在使用時它們的吸收液量及通氣流量均有規定,但因捕集器具種類不同,效率也不同,故對於某測定對象物質必須先確認其捕集效率。至於捕集效率的好壞一般而言如下表二:
表二、各種特性對捕集效率之影響
| 特性 | 條件 | 捕集率 |
| (1) 氣體與液體之接觸表面 | 氣泡小、接觸面大 | 高 |
| (2) 氣體在捕集液中之溶解度 | 溶解度高 | 高 |
| (3) 氣泡的滯留時間 | 接觸時間長 | 高 |
| (4) 揮發性大時溫度之影響捕集率 | 溫度低 | 高 |
但本方法所使用的捕集器具大多配戴不便且易裂,因此若考慮個人採樣方式,則液體捕集法並不是一個很理想的方法。如果捕集液是有機溶劑,則更需考慮萬一洩漏時捕集液所可能產生之危害,故此法已逐漸被固體捕集法所取代。
2.固體捕集法
固體捕集法是利用將氣體樣品通過固體捕集管時,氣體中之待測化合物被吸附在固體粒子上之捕集方法。捕集管體積小易攜帶,是很好的採樣設備,但是目前對低分子量的氣態化合物,尤其是四個碳以下且沸點低於丁烷的有機化合物,通常並沒有理想的固體捕集管。在定量分析時需計算化合物從固體吸附管中脫附出來的脫附效率。常見的固體粒子吸附材料有:
(1)矽膠 (Silica gel) ─具有強極性之官能基,能採集極性大的化合物,但很容易被空氣中的水氣吸附,而影響到它的有效採集體積。
(2)活性碳─活性碳因種類及活性化的條件而具有不同的吸附特性,一般而言其對無極性或低極性之有機溶劑有較佳的吸附力。
3.直接捕集法
直接捕集,顧名思義即是沒有經過吸收、吸附過程,而用捕集容器直接採集空氣樣品的方法,但是在此三種方法中,本方法所使用的捕集容器體積最大,於採集大量樣品數時,則會造成相當大的不方便。且若所採集的氣體濃度太低有時需加以濃縮才能以儀器分析,也可能因濃縮過程而造成誤差。常見的捕集容器有:
(1)氣體採樣袋 (gas sampling bag)
主要有聚氟乙烯 (polyvinyl fluoride)袋、聚氯亞乙烯 (poly-chlorovinylidene) 袋和聚酯 (polyester)袋。因採樣袋的材料與測定物之特性,濃度可能會有不同程度的降低或因共存物的相互作用而引起濃度變化;故使用採樣袋應作適當的選擇。在使用採樣袋時,需預先用氮氣或清潔空氣沖洗其內部,以消滅殘留不純物。採樣袋應盡可能放在室溫及陰暗處以避免日光直射或高溫,而造成的體積變化及濃度改變等。
以採樣袋作為捕集器時,若化合物之性質於採樣袋之材質特性相似時,該化合物可能會充塞於聚合物分子間之微小空隙中。當採樣之溫度趨近於該化合物沸點時,由於受溫度影響,將使充塞於微小空隙之物質滲出,最後導致採樣袋劣化。
(2)玻璃採樣瓶 (glass bulb)
此採樣瓶是一定體積且內部為接近真空狀態之玻璃瓶,使用時是利用壓力原理吸引空氣樣品至瓶內。使用本方法採樣時需注意下列諸項因素:
容器內的壓力指示。
若直接自壓縮鋼瓶充填氣體玻璃採樣瓶時,需利用壓力調節器,調節瓶內之壓力。
真空捕集瓶內的待測空氣樣品應避免日光直射或高溫,並儘可能及早進行分析。
捕集瓶使用前,應以氮氣或清潔空氣沖洗2~3次,以去除污染物之影響。
(3)注射針筒直接抽取
目前常用的注射針筒為具有雙向之氣密式注射針筒,可直接定量吸取氣體樣品。分析氣態化合物時可能遭遇之問題大致歸納如下:
氣體自鋼瓶中如何導引出來。
氣體的定量方法。
氣態化學物質懼光之情況。
經濟效益。
與接觸物之安定性。
(二)目前常用的〝氣態〞樣品捕集方法之設備如圖四至圖八所示:
圖四衝擊式採樣瓶
圖五冷凝捕集管
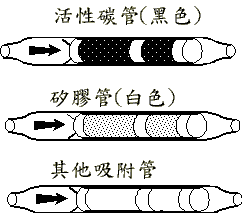
圖六固體吸附管
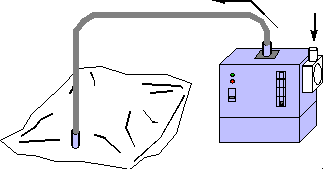
圖七氣體採樣袋

圖八玻璃採樣瓶
二、檢量樣品配製
配製氣態化合物的檢量線樣品時,首先需將氣體自鋼瓶有效地導引出來;一般而言,有鋼瓶直接抽取法,採樣袋收集法和排液集氣法。鋼瓶直接抽取法係自含有血清塞之鋼瓶出口閥端直接抽取所需量之標準氣體 (如圖九),此方法可節省標準氣體的消耗,但需較高的操作技巧。採樣袋收集法是將鋼瓶氣體直接導引入減壓之採樣袋中,本方法操作簡易,但會浪費標準氣體,且待測氣體分子可能會吸附在袋壁上,而影響準確度。排液集氣法之氣體取出步驟如圖十,係以一氣體集氣管,頂端套上血清塞,內盛滿與待測氣體不互溶之溶劑,而以導管將鋼瓶之氣體導引至集氣管,並將氣體充滿於集氣管中,至管內外的溶液液面等高為止(集氣管內的壓力等於外界氣壓)。當氣體收集好後,再進一步以氣密式注射針筒抽取定量的氣體,並以一合適的吸收液溶解抽取出之氣體,以配製檢量溶液,或把抽取出之氣體注入一定體積的採樣袋內,以配製較低濃度之標準氣體。
表三為此三種方法的比較。而檢量樣品的製作一般可分成三種,可以氣密式注射針筒抽取定量氣體(1)直接注入儀器中,或(2)注入含定量乾淨空氣之採樣袋中,或(3)注入定量溶液中配製檢量溶液。
表三、 定量取出鋼瓶中氣體之方法
| 氣體導引之方式 | 方法 | 優點 | 缺點 |
| 鋼瓶直接抽取法 | 以氣密式注射針筒自含有血清塞之氣體鋼瓶出口閥直接抽取氣體 ( 如圖九 ) | 節省標準氣體之耗費 |
|
| 採樣袋法 | 把氣體直接導引入減壓之採樣袋內 |
|
|
| 排液集氣 | 把氣體導引入排液集氣管中 ( 如圖十 ) |
| 標準氣體之消耗量較大,且需和不溶於排液管之液體互不相容,於壓力計算時需扣除排液管液體之分壓 |
氣體之檢量溶液配製法是利用裝有定量溶劑,且套有血清塞入口之量瓶,以氣密式注射針筒插入並使針頭浸於溶劑液面之下,以增加氣體之溶解,並且不時的搖動液瓶使其捕集率加大;同時為了防止氣體外洩,在操作上需作稍微的變化,如圖十一所示。
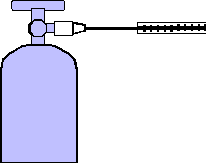
圖九以針筒抽取鋼瓶中氣體
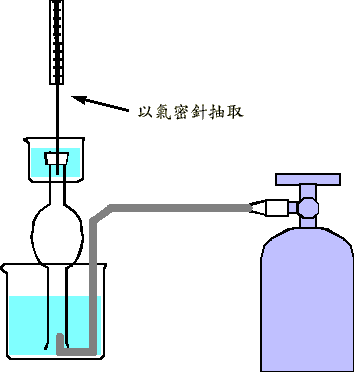
圖十 排液集氣法
1.檢量線製作
檢量線製備是以氣密式注射針筒直接抽取等大氣壓的定量氣體後,馬上關閥,並將其插入溶劑表面內再開閥,此時先勿注射;而是把此針筒靜止在原位,直到注射針內的氣體溶解,針筒內會因所含之氣體部份溶解而產生真空現象,所以瓶內較高的壓力會壓迫溶劑進入針筒內而加速氣體的溶解;再以振搖及反覆刷洗針筒來確保氣體完全溶解。以此方式,改變氣體之抽取體積來配製不同的檢量溶液,並以儀器分析後即可得檢量線。此方法應注意化合物溶劑中之最高溶解量。另一方法是取定量的純氣體直接以氣層分析儀(GC)分析,所得之波峰面積與濃度即可做檢量線,但此方法較無法配製濃度較低之樣品。若需分析濃度較低之樣品,則可把上述之檢量溶液再稀釋後為之。
2.壓力補償
排液集氣法是利用集氣管內外壓力之平衡,而得一相當於當時大氣壓力的氣體容積。但集氣管內壓實含所排液體之蒸氣分壓,因此若為精確計算定量取自管內待測氣體之實際含量,應以下式修正之。
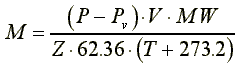
M =修正後所收集待測氣體之質量(μg)
P =外界壓力(mmHg)
Pv=當時溫度下所排液體之分壓(mmHg)
V =取用待測氣體的體積(μL)
MW=待測氣體的分子量(gmol-1)
Z =氣體壓縮常數
T =攝氏溫度(℃)
62.36為氣體常數(mmHgLmol-1K-1)
273.2為絕對溫度,相當於0℃(單位為K)
Z值可以下式計算
Z=a+bP+cPT+dPT2
a,b,c和d為參數;就1.3丁二烯而言,在10-75℃。
420~1050mmHg的狀況下,a=1.00095,b=-4.8489×10-5,
c=4.44816×10-7和d=-1.15744×10-9
一般Z值為1
參考資料:
- NIOSH Manual of Analytical Methods, 3rd ed., U.S. Department of Health and Human Services, 1984.
- Air Sampling Instruments 7th. ed., American Conference of Gove-rnmental Industrial Hygienists Cincinnati, Ohio, 19810.
- Methods of Air Sampling and Analysis, 2nd., M. Katz, ed., Amer. Publ. Heal. Assoc. Intersociety Cominittee, Washington, DC, 1977.
- Methods of Air Sampling and Analysis, 3rd ed., J. P. Lodge, Jr., ed, Lewis Publishers, Inc, Chelsea, MI, 1988.
- 發布單位:職業危害評估研究組
- 更新日期:111-07-25
- 點閱次數:



